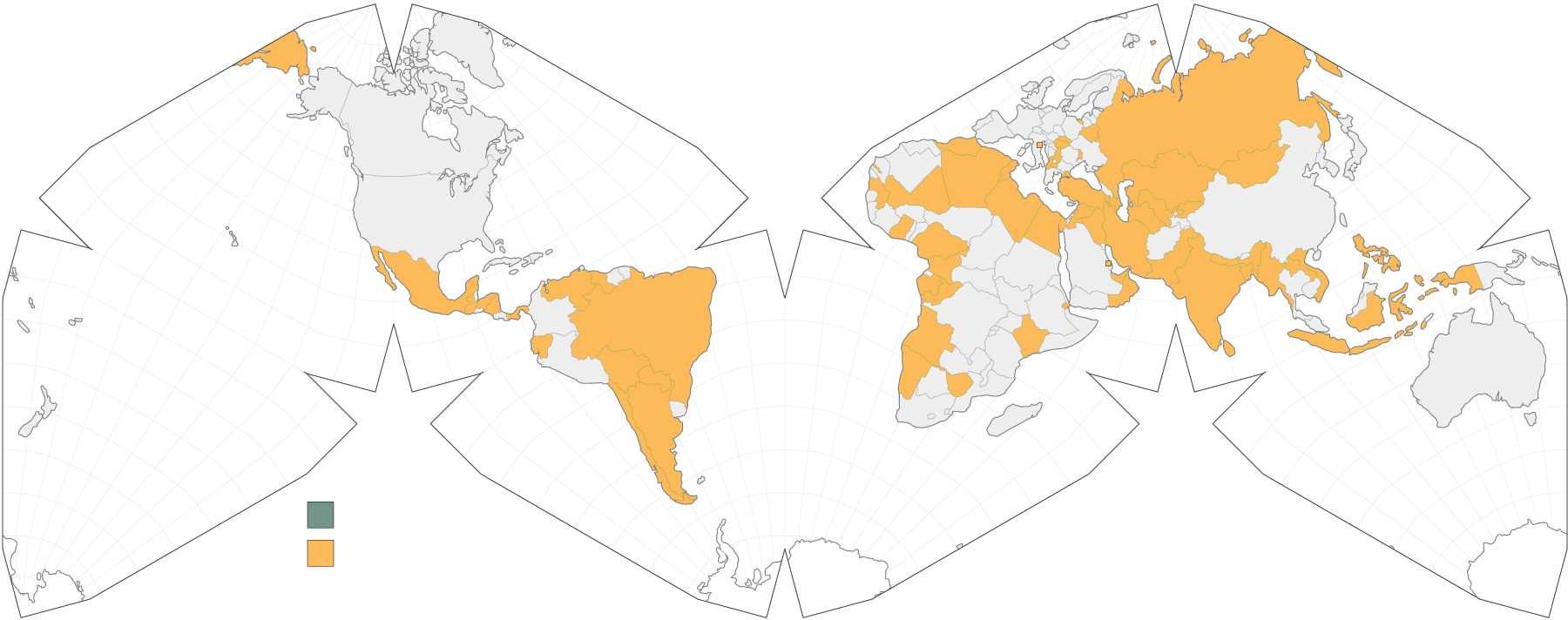
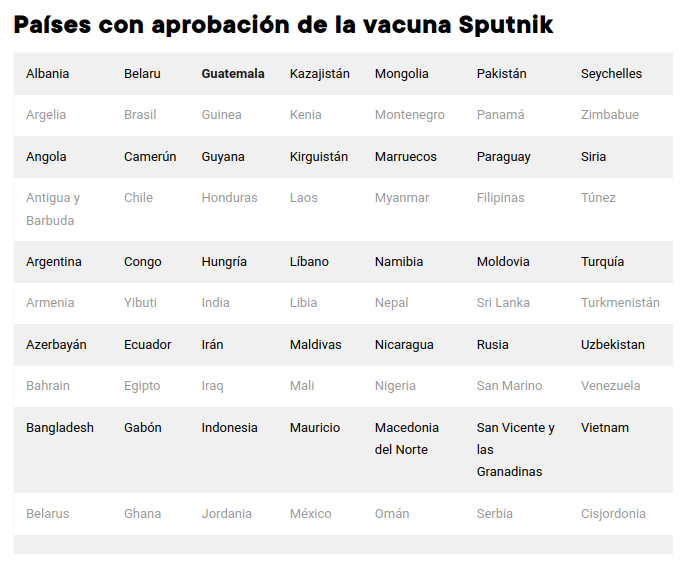
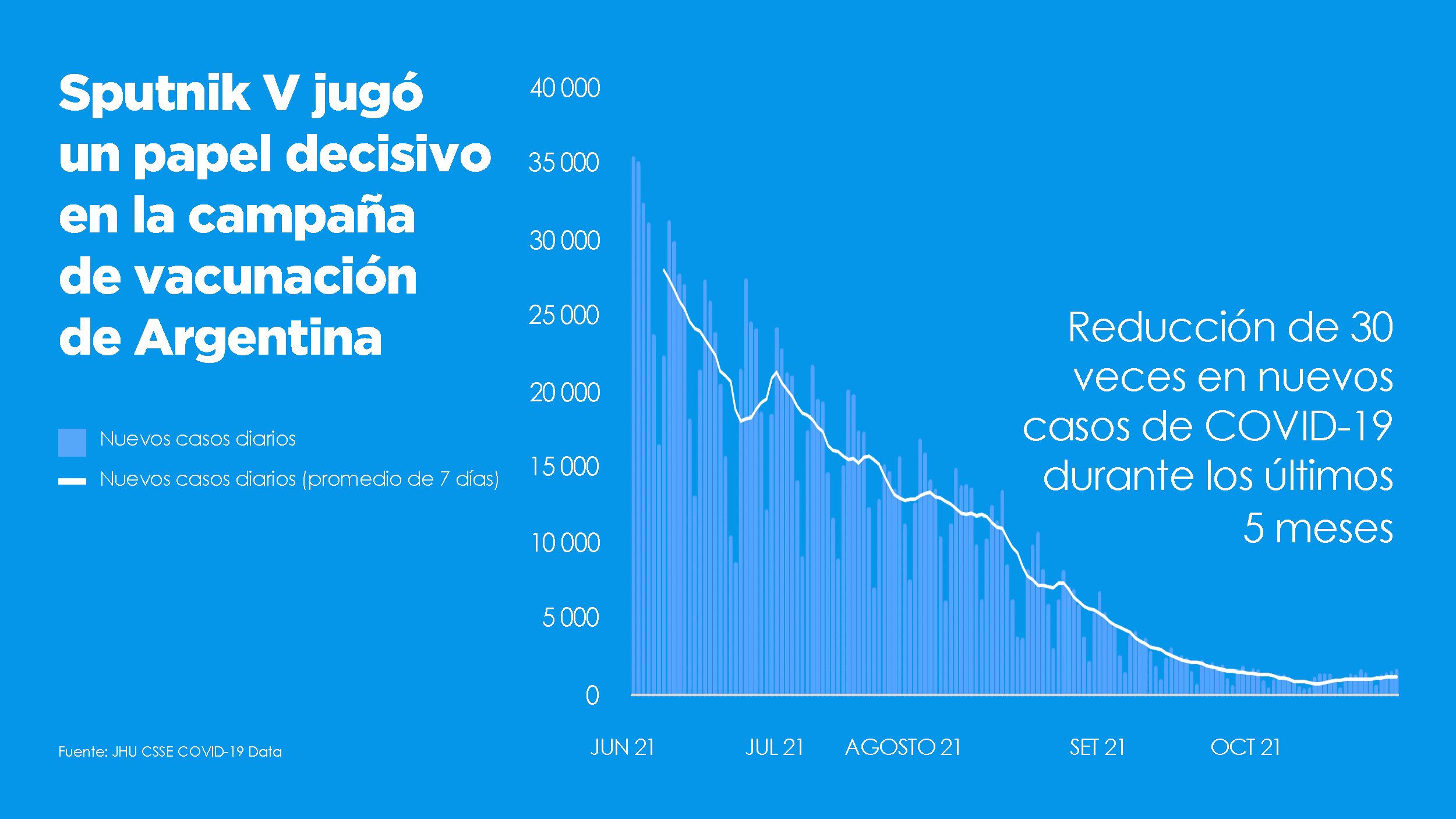
Más de 70 países en los que viven 3 mil millones de personas han recibido cargamentos de la vacuna Sputnik V (o Gam-Covid-Vac), elaborada por el Instituto de Investigación Gamaleya, perteneciente al Ministerio de Sanidad de Rusia. Es una vacuna con una tasa de eficacia del 91,6% que hasta ahora no ha reportado efectos adversos y que el país euroasiático comenzó a distribuir hace cerca de un año en países de América Latina como Venezuela, México, Brasil, Argentina, entre otros.
Uno de los temas en torno a este fármaco, que ha llamado la atención mediática, es el tiempo que ha tardado en obtener la aprobación por parte de la Organización Mundial para la Salud. Ello no impide su uso, pero ser admitida como vacuna completa facilita el ingreso de quienes han sido inoculados a la mayoría de los países de la Unión Europea y Estados Unidos.
Gamaleya produjo la vacuna a partir de una combinación de dos adenovirus llamados Ad5 y Ad26 que han sido probados como vacunas durante varios años. Al combinarlos, los investigadores rusos esperaban evitar una situación en la que el sistema inmunitario pudiera aprender a reconocer la vacuna como un objeto extraño que debía ser destruido.
¿Qué y cómo aprueba la OMS?
La OMS evalúa la calidad, seguridad y eficacia de cada vacuna para incluirla en la Lista de Uso de Emergencia, para ello deben fabricarse cumpliendo las Buenas Prácticas de Manufactura (BPM) bajo un sistema de gestión de calidad. Se trata de normas de procedimiento orientadas a alcanzar unos determinados estándares de calidad en el producto final.
El código BPM se estableció por primera vez en 1968 por los especialistas de la OMS, casi todas sus reglas se basan en normativas de la Unión Europea (UE) o de la llamada Conferencia Internacional sobre Armonización, integrada por la propia UE, Estados Unidos y Japón. La certificación BPM tiene un carácter más ramificado, así que algunos países, incluido Rusia, cuentan con sus propias reglas regionales de procedimiento.
Tanto la OMS como la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) han autorizado las vacunas contra la covid-19 de Pfizer-BioNTech, Moderna, AstraZeneca y Johnson & Johnson. Además, la agencia de la ONU aprobó las inmunizaciones chinas Sinopharm y Sinovac.
Los solicitantes se comprometen a completar el desarrollo del producto y solicitar la precalificación de la OMS una vez que el producto tenga la licencia. Para ello deben incluir:
- Datos de calidad de fabricación.
- Datos no clínicos y datos clínicos.
- Un plan para monitorear la calidad, seguridad y eficacia en el campo y el compromiso de presentar nuevos datos a la OMS tan pronto como esta nueva información esté disponible.
- Detalles del etiquetado.
Otro de los detalles apremiantes sobre la mencionada aprobación es que constituye un requisito para las vacunas que se suministran por medio del Mecanismo COVAX por lo que la aprobación ayudaría supuestamente a los países a acelerar su propia autorización regulatoria para importar y administrar vacunas contra la covid-19.
Contrario a sus buenas intenciones y su real propósito, el mecanismo COVAX terminaron favoreciendo a los países más ricos.
Datos de @supereder para el @isrobinson_pic.twitter.com/oN5jZx9fGx— MV (@Mision_Verdad) June 28, 2021
¿Cómo ha evolucionado Sputnik V?
Junio, 2020: Inicio de ensayos clínicos.
- Agosto, 2020: El presidente Vladimir Putin anunció que el órgano regulador sanitario ruso había aprobado la vacuna, los ensayos de fase 3 ni siquiera habían comenzado. Ante las críticas de expertos, Rusia aclaró que la aprobación era un "certificado de registro condicional" que dependería de los resultados positivos de los ensayos de la fase 3. Se reclutaron voluntarios para el ensayo en Bielorrusia, Emiratos Árabes Unidos y Venezuela.
- Septiembre, 2020: Gamaleya publica los resultados de su ensayo de fase 1/2 revelando que el fármaco producía anticuerpos contra el SARS-CoV-2 y efectos secundarios leves.
- Noviembre, 2020: El Fondo Ruso de Inversión Directa (RDIF, por sus siglas en inglés) anunció las primeras pruebas preliminares de su ensayo de fase 3, que indican que la vacuna es eficaz. Basándose en 20 casos de Covid-19 entre los participantes en el ensayo, estimaron que la vacuna demostraba una eficacia del 92%.
- Diciembre, 2020: Se amplía el ensayo a 78 casos. Gamaleya unió fuerzas con la farmacéutica AstraZeneca, que fabrica una vacuna basada en un adenovirus de chimpancé, ambos equipos combinaron sus vacunas para ver si la mezcla puede aumentar la eficacia de la vacuna Vaxzevria (llamada AZD1222 o AstraZeneca, también Covishield en India).
- Enero de 2021: Gamaleya inició un ensayo en el que administraron a las personas sólo la primera dosis de adenovirus Ad26, el mismo adenovirus de la vacuna de dosis única de Johnson & Johnson. Bautizaron esta versión de dosis única como "Sputnik Light".
- Febrero, 2021: Publicación de resultados en la revista Lancet demostrando gran eficacia tras dos dosis y sin efectos secundarios graves. Nadie que recibiera la vacuna experimentó un caso grave de covid-19.
- Febrero, 2021: El director de Gamaleya declara en televisión que Sputnik Light probablemente sólo proporcionaría entre cuatro y cinco meses de protección.
- El Comisario de Mercado Interior, Thierry Breton, que dirige el grupo de trabajo sobre vacunas del Ejecutivo comunitario declara a la televisión: "No necesitamos en absoluto el Sputnik V".
- Mayo, 2021: Rusia anunció que Sputnik Light proporcionaba una eficacia del 79,4%, pero no publicó los detalles del estudio ni dijo cuánto duraría la eficacia. Después de que la versión de una sola dosis de la vacuna se extendiera en Argentina, un estudio determinó que su eficacia allí era de entre el 78,6 y el 83,7%.
- Junio, 2021: Un estudio científico publicado en Argentina evaluó la capacidad neutralizante de la Sputnik V contra la variante Lambda, también conocida como “Andina” o C.37, que ha estado prevaleciendo en América Latina y fue catalogada "de interés" por la OMS.
- Julio, 2021: Autoridades rusas anunciaron que la mezcla de Sputnik V con la vacuna de AstraZeneca no causaba efectos adversos ni nuevos casos de covid-19; mientras la revista científica Nature, una de las más prestigiosas del sector a nivel mundial, informaba que un creciente número de evidencias recabadas en todo el mundo avalan su fiabilidad.
- Julio, 2021: Autoridades chinas anunciaron que Sputnik V forma parte de un nuevo ensayo que evalúa su eficacia cuando se combina con la vacuna CanSino.
- Julio, 2021: Un estudio publicado reveló que los anticuerpos inducidos por la vacuna pueden neutralizar la variante Delta, aunque no con la misma eficacia que contra la versión original del virus.
- Agosto, 2021: Se anuncian resultados similares tras mezclar Sputnik Light con la inyección de Astrazeneca en un ensayo realizado en Azerbaiyán. La mezcla de Sputnik Light con las vacunas de AstraZeneca, Sinopharm y Moderna también resultó segura. Autoridades rusas anuncian que los ensayos preclínicos para una versión intranasal de Sputnik V han finalizado, y los ensayos en humanos podrían comenzar pronto.
- Octubre, 2021: Gamaleya anunció que Sputnik Light demostró una eficacia del 70% contra la variante Delta, el estudio aún no se ha publicado en una revista científica.
- Noviembre, 2021: Investigadores argentinos publican un artículo que muestra que la vacuna reduce la infección en un 88,1% y las muertes relacionadas con el Covid-19 en un 98,3% en personas mayores de 60 años.
El camino sinuoso para su aprobación (que no termina)
Aunque en junio pasado el director general de la OMS, Tedros Adhanom Ghebreyesus, afirmó que la aprobación de la Sputnik V era una decisión técnica "de un grupo que trabaja de manera independiente y que informará de sus conclusiones una vez que concluya sus labores"; muchos pasos formales propios de la agencia quedaban por delante, pero también uno que otro precedente en el que la propaganda occidental se ha afincado para invisibilizarla y atacarla puntualmente.
En Europa, los entes reguladores iniciaron una revisión continua de Sputnik V desde marzo, esto significa que si la EMA la aprueba, muchos países europeos podrían adoptar la vacuna. En abril, Anvisa, el organismo regulador de vacunas de Brasil, la rechazó basándose en una serie de preocupaciones, entre ellas la posibilidad de que los adenovirus de las vacunas no hubieran sido desactivados adecuadamente. Tras semanas de tensa confrontación, Brasil dio luz verde en junio, pero con algunas condiciones, como la de limitarla sólo a adultos sanos.
A mediados de junio, un grupo de expertos de la OMS detectó irregularidades en la producción de Sputnik V en una de las nueve plantas visitadas ubicada en Ufá (Rusia). En el documento publicado (PDF) en el sitio web de la OMS, la mayoría de las observaciones están relacionadas con cuestiones de esterilidad y medioambientales, no con el proceso de fabricación de la vacuna. Aun cuando los expertos no cuestionaron la seguridad de la vacuna en ningún momento se tomó la decisión de paralizar todo el proceso de validación de Sputnik V.
Poco después, el portavoz del presidente de Rusia, Dmitri Peskov, afirmó que el fabricante de Sputnik V había corregido las observaciones realizadas por la OMS sobre el cumplimiento de los requisitos para producir vacunas contra el coronavirus.
En agosto pasado Mariangela Simao, subdirectora general de la OMS, explicó que "Sputnik V está siendo sometida a trámites jurídicos" y detalló que se estaba considerando incluir la vacuna rusa en el mecanismo COVAX. Agregó que "Todavía las fechas son inciertas para la finalización del proceso, pero esperamos que esto suceda a mediados de septiembre".
En septiembre, el subdirector de la Organización Panamericana de la Salud (OPS), Jarbas Barbosa, anunció que la aprobación de Sputnik V por parte de la OMS estaba en suspenso a la espera de una nueva inspección de la planta del productor. "Durante una inspección de una de las fábricas que forman parte de la producción de Sputnik V, se comprobó que la planta no estaba de acuerdo con la aplicación de Buenas Prácticas de Manufactura", explicó.
En octubre pasado, Simao declaró que la agencia aún no había recibido la información completa sobre la vacuna y explicó que el proceso de aprobación estuvo en espera debido a un procedimiento legal relacionado con el envío del formulario con la información necesaria a la OMS. Asimismo informó que el proceso de precalificación está en marcha y entra en su fase final. Un grupo de supervisores del organismo internacional visitaría Rusia para completar todas las inspecciones y los trámites necesarios.
En esos mismos días la científica jefe de la OMS, Soumya Swaminathan, dio a entender que el organismo internacional podría reconocer Sputnik V antes de finales de año y que "existen algunos documentos legales que deben ser firmados por ambas partes antes de que el proceso continúe", ese era el principal impedimento para que la organización aprobara la vacuna para uso de emergencia.
El ministro de Salud ruso, Mikhail Murashko, se reunió en Ginebra con el director general de la OMS, Tedros Adhanom Ghebreyesus, a comienzos de octubre pasado y afirmó que la aprobación sería en este noviembre debido a que todas las barreras habían sido despejadas y solo quedaban algunos trámites por completar. "Se escuchó la posición de Rusia sobre la promoción y el registro de la vacuna Sputnik V, hemos eliminado todas las preguntas para hoy", agregó.
BREAKING | Russia’s Health Minister Mikhail Murashko on #SputnikV @WHO authorization: All barriers for SputnikV authorization by WHO have been removed, only minor administrative procedures need to be sorted. It has been confirmed by @WHO Director-General @DrTedros.
— Sputnik V (@sputnikvaccine) October 2, 2021
Cпаси́бо, Mikhail Murashko, #Russia Health Minister, for your visit and constructive meeting about the new @WHO initiatives such as: #WHOAcademy, BioHub, and Hub for Pandemic and Epidemic Intelligence in Berlin, as well the WHO Emergency Use Listing process for #COVID19 vaccines. pic.twitter.com/sC1JLqSZuR
— Tedros Adhanom Ghebreyesus (@DrTedros) October 1, 2021
Por otra parte, Reuters publicó en esos días que, según datos de "una fuente", era poco probable que la EMA decidiera aprobar el fármaco hasta al menos el primer trimestre de 2022, ya que aún faltan algunos datos necesarios para la revisión.
"La EMA pidió un expediente más completo sobre la producción, detalles sobre cómo se produce la vacuna. Cuando tengan este expediente, también podrán saber dónde pedir las inspecciones", dijo la supuesta fuente al referirse tanto a la producción del ingrediente activo como al embotellado del producto final.
¿Guerra comercial o dificultades técnicas?
Otros medios han declarado abiertamente que la Sputnik V, por su grado de eficacia, entraría a competir abiertamente con las vacunas desarrolladas por las transnacionales Pfizer y/o Moderna, estas forman parte del entramado corporativo que ha convertido a dichos fármacos en mecanismos de coerción (PDF). No habría ninguna paranoia si se pensara que se trata de un retraso intencionado y que este sería, no solo un tensor más en las disputas entre Europa (y Estados Unidos) y Rusia, sino que cuestiona el supuesto dogmatismo occidental respecto al libre mercado.
Además de las dos producidas por Gamaleya (Sputnik V y Light), Rusia cuenta en la actualidad con otras tres vacunas contra la covid-19: EpiVacCorona y EpiVacCorona-N, creadas por el Centro de Virología y Biotecnologías Vector; y CoviVac, producida por el Centro de Investigaciones y Desarrollo de Sustancias Inmunobiológicas Chumakov, se desconoce en qué paso del sinuoso camino aprobatorio se encuentran.
Otra de las consecuencias del retraso en cuestión es la cantidad de dificultades que ocasiona a la movilidad, quienes deseen ingresar a Estados Unidos deben haber sido vacunados con las que la Administración de Medicamentos y Alimentos (FDA, por sus siglas en inglés) ya aprobó: Pfizer, Moderna y Johnson & Johnson. También AstraZeneca, Covishield, Sinopharm y Sinovac, avaladas por la OMS.
Algo parecido ocurre con la UE, pero ya algunos países han relajado las medidas de restricción de ingreso en la medida en que aumenta la lista de "países seguros" con las tasas de vacunación.
En septiembre pasado, Barbosa anunció que los miembros de la OPS resolvieron que el acceso a las vacunas no debe ser utilizado como una barrera: "Es un momento en que muchas personas tienen acceso solo a unas vacunas y no a otras. Es una decisión que cada país debe tomar, pero la recomendación de la OPS es que no sea una barrera para los viajes".
Se ha discutido ampliamente los pros y contras que ocasionan las limitaciones de movilidad (entre otros derechos) impuestas a partir de las vacunas, sobre todo cuando Estados Unidos y Europa han participado del acaparamiento de vacunas anticovid-19, no deja de ser irónico que limiten el ingreso a personas vacunadas con fármacos que son distribuidos sin exigencias injerencistas a sus países de procedencia.
As @POTUS prepare prepares to meet with #G7 leaders this morning, new analysis from @ONECampaign shows the US has purchased at least 453 million excess COVID-19 vaccine doses that could be used to vaccinate people in the world’s poorest countries. https://t.co/YbOx1jwRnR pic.twitter.com/2JRtROzJKl
— ONE in America (@ONEinAmerica) February 19, 2021
Barbosa agregó que la OPS espera que la elección por determinadas vacunas sea un certificado para ingresar a un país: "La única vacuna que puede ser exigida por un país es para la fiebre amarilla según el reglamento internacional".
La segunda dosis de Sputnik V ha sido otro nudo crítico, debido a que ha limitado la inoculación del esquema completo y dificultado la posibilidad de movilidad de las personas inoculadas. Argentina, que ha comenzado a fabricarla, ha completado el esquema de 25,7 millones con su propia producción y algunos lotes llegados de Rusia, aun le faltan casi 8 millones para llegar a los 33,6 millones que recibieron la primera dosis.
Una buena noticia es que podrían ser suplidos por dosis de Pfizer o AstraZeneca, en caso que hubiese un mayor stock de estas marcas, debido al buen resultado que arrojaron los ensayos de combinación de vacunas.
Recientemente, el ministro de Industria y Producción, Jorge Arreaza, confirmó que Venezuela ha recibido más de tres millones de dosis y que se espera poder cumplir pronto la meta que se había planteado de los 10 millones de fármacos, tras el acuerdo firmado en diciembre de 2020 con Rusia.
Queda por ver cómo se desarrolla este proceso y cuáles serán las acciones que desarrollará la burocracia europea en función de los intereses corporativos que le sostienen y gobiernan.